- 概要
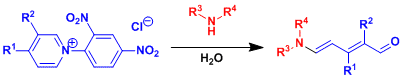
ピリジニウム塩は2級アミンの求核付加を受けて開環し、5-aminopenta-2,4-dienal(Zinckeアルデヒド)を与える。
ピリジニウム塩は2級アミンの求核付加を受けて開環し、5-aminopenta-2,4-dienal(Zinckeアルデヒド)を与える。
2,5-ジアルコキシテトラヒドロフランと一級アミンからピロールを合成する手法。
シロキシジエンは俗にDanishefsky(-北原)ジエンとよばれる。二つの電子供与性置換基を持つためにHOMOエネルギーレベルが高く、電子不足ジエノフィルに対する、Diels-Alder反応およびヘテロDiels-Alder反応に高い活性を示す。
Disodium Iron Tetracarbonylを俗にCollman試薬と呼称する。アルキルハライドと反応してアルデヒドやケトンを与える。
フェノールをチオカルバメート化もしくはチオカーボネート化し、熱転位、引き続く加水分解によりチオフェノールを合成する手法。
3成分連結型反応(3-component reaction)の一種。ノルボルネンを共触媒とするパラジウム触媒の存在下、溝呂木-Heck反応をはじめとするパラジウムクロスカップリングをおこなうと、オルト位のC-H活性化が起こり、アルキルハライドとの炭素-炭素結合の形成がおこなえる。

SN2置換反応などにおいては、通常強塩基にて脱プロトン化を行い、アニオンを生成させたところに求電子剤との反応が行われる。いかし収率向上や溶解性などの問題から、DMFやDMSOなどの非プロトン性極性溶媒の使用が多く求められる。これらは高沸点ゆえに除去が難しく、また比較的高価なため大量合成時には不向きとなる。
水-非極性有機溶媒の2相系でイオン性の反応を行う目的で、相間移動触媒(Phase-Transfer Catalyst, PTC)が用いられる。これは2つの相を行き来できる両親媒性触媒のことであり、多くは長鎖アルキル鎖をもつ四級アンモニウム塩やクラウンエーテルがPTCとして働く。
安価で後処理容易な無機塩基の使用、有機溶媒の使用量低減、回収性の悪いDMFやDMSOなどの使用回避、実験操作の易化、反応性の向上、副反応の抑制などが期待でき、とくに大量スケール合成時に多くの利点をもたらす。グリーンケミストリーの観点からも注目されている触媒系である。

二重結合をもつ炭化水素に対し求電子的付加反応をおこなう際、結合する水素原子数の多い方の炭素のほうに、電気的に陽性な原子団が結合する。この経験則をマルコフニコフ則(Markovnikov's rule)と呼ぶ。
水素原子or置換数を指して"富めるものはますます富める(the rich get richer)"とすれば覚えやすい。

α-ハロカルボアニオンを用いる有機ホウ素化合物の増炭反応。ホウ素化合物にキラル補助基を導入しておくことで不斉合成も行える。

ビニルアルコキシカルベンペンタカルボニルクロム錯体(フィッシャーカルベン錯体)とアルキンを反応させることで、フェノールを得る手法。
第一段階目終了時点では、生成物はクロムカルボニル錯体として得られる。これを酸素やCANなどを用いる酸化的処理によって解離させ、フェノールが得られる。

ベンジリデンアセタールをN-ブロモスクシンイミド(NBS)で処理することで酸化的に開環体を与える反応。立体的にすいている位置に臭素が導入される。

ルテニウム(II)ポリピリジル錯体、イリジウム(I)フェニルピリジル錯体などは、可視光(λ=400-700nm)照射下に光酸化還元触媒(Photoredox Catalyst)として機能する。
強力な紫外線(UV)照射装置を使わずに、穏和に反応を進行させられるため、副反応の抑制が期待できる。また操作も簡便で、環境にも優しいクリーンな反応形式の実現も見込める。
有機合成領域ではもちろん、光をエネルギー源として活用するという技術的観点からも注目を集めている触媒系である。

炭素ラジカルを電子不足複素環へと求核付加させる形式で、芳香族置換反応を行う反応。ラジカル前駆体としてはカルボン酸+1電子酸化剤の組合せがよく用いられるが、C-H結合活性化を経て行うことも可能。

アルキンは適当なルイス酸触媒存在下に、水和反応を起こす。触媒金属としては特に多重結合と親和性の高い、水銀や貴金属が多用される傾向にある。ほとんどの場合、マルコフニコフ則に従う化学選択性にて化合物が得られる。

1,2-ジオールをスズアセタールで保護すると、一方のアルコールだけに反応を生じさせることができる。よく応用される変換はBnBrやTsClを用いる位置選択的保護、もしくはBr2を用いる選択的酸化反応などである。
条件によってはスズを触媒量に減ずることも可能。

アリルカーバメートの脱水反応により系中でアリルシアナート種を生成させると、これは速やかに転位してアリルイソシアナートを与える。
反応形式面ではOverman転位と同様であるが、本法は圧倒的に活性が高く、低温(0℃以下)で進行する。また活性種の嵩が小さいため、立体的に混みあった位置への転位も可能である。引き続きアルコールと反応させることで、任意のカーバメート保護アミンも得られる。